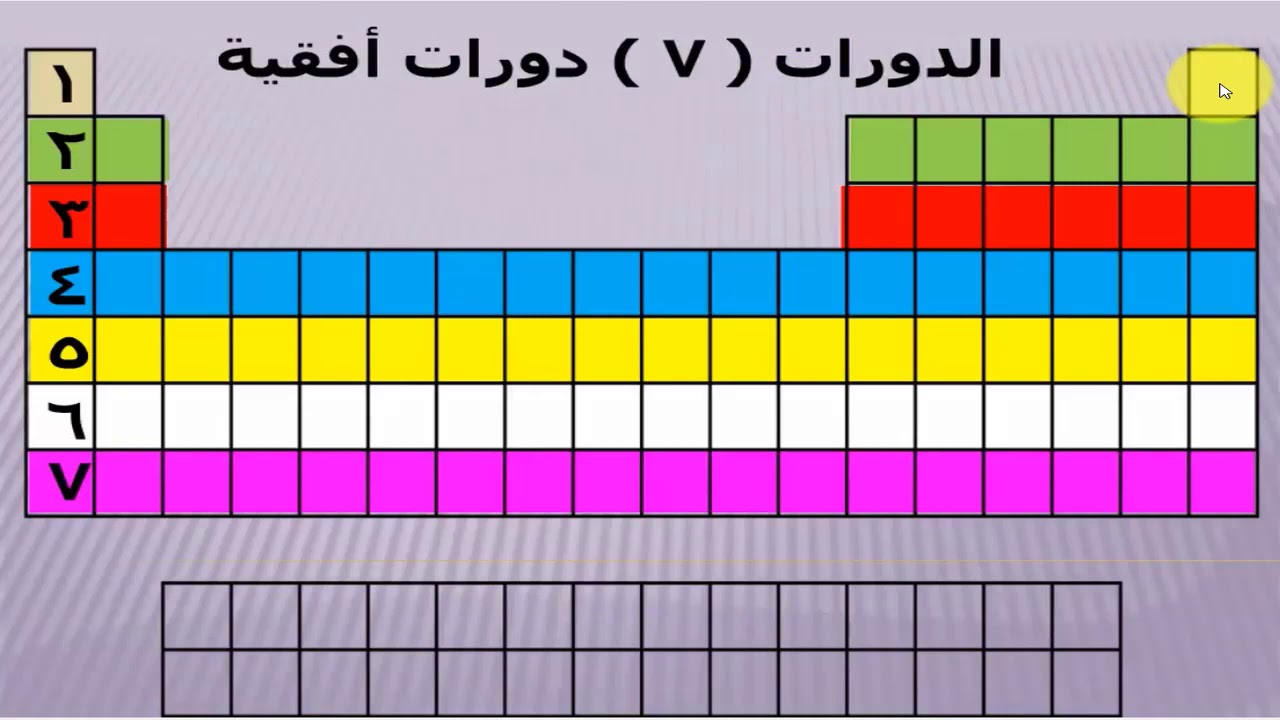
رتبت العناصر في الجدول الدوري الحديث حسب تزايد العدد الذري، بحيث يمثل كل عنصر عدداً ذرياً فريداً يعبر عن عدد البروتونات في نواة ذرة هذا العنصر.

الخصائص الدورية للعناصر
{ |}
|}
يُظهر الجدول الدوري أن العناصر التي تقع في نفس المجموعة (العمود الرأسي) لها خصائص كيميائية متشابهة، وذلك لأنها تحتوي على نفس عدد الإلكترونات في غلافها الخارجي. وعلى العكس من ذلك، فإن العناصر التي تقع في نفس الدورة (الصف الأفقي) لها خصائص فيزيائية متشابهة، وذلك لأنها تحتوي على نفس العدد من مستويات الطاقة.
{ |}
|}
1. الفلزات


تقع الفلزات في الجزء الأيسر السفلي من الجدول الدوري، وهي تتميز بأنها صلبة لامعة وسهلة التشكيل، ولها موصلية كهربائية وحرارية عالية.

من الأمثلة على الفلزات: الصوديوم والحديد والذهب.

تتفاعل الفلزات بسهولة مع اللافلزات لتكوين مركبات أيونية، وهي تميل إلى فقدان الإلكترونات في التفاعلات الكيميائية.
{ |}
|}
2. اللافلزات
{ |}
|}
تقع اللافلزات في الجزء الأيمن العلوي من الجدول الدوري، وهي تتميز بأنها غازات أو مواد صلبة غير لامعة، ولها موصلية كهربائية وحرارية منخفضة.

من الأمثلة على اللافلزات: الأكسجين والكلور واليود.

تتفاعل اللافلزات بسهولة مع الفلزات لتكوين مركبات أيونية، وهي تميل إلى اكتساب الإلكترونات في التفاعلات الكيميائية.
3. أشباه الفلزات
{ |}
|}
تقع أشباه الفلزات في المنطقة الفاصلة بين الفلزات واللافلزات في الجدول الدوري، ولها خصائص متوسطة بينهما.
من الأمثلة على أشباه الفلزات: السيليكون والجرمانيوم والزرنيخ.

يمكن لأشباه الفلزات أن تتصرف إما كفلزات أو كلافلزات، اعتمادًا على الظروف، وتميل إلى تشكيل مركبات تساهمية.

4. العناصر الانتقالية

تقع العناصر الانتقالية في الجزء الأوسط من الجدول الدوري، وتتميز بأنها معادن صلبة ولها موصلية كهربائية وحرارية عالية.

من الأمثلة على العناصر الانتقالية: الحديد والنحاس والزنك.
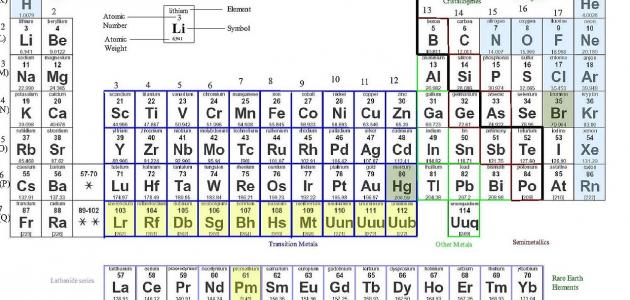
تميل العناصر الانتقالية إلى تشكيل مركبات ذات درجات أكسدة متعددة، ويمكن أن تكون بمثابة محفزات في التفاعلات الكيميائية.
5. العناصر النادرة
تقع العناصر النادرة في الجزء السفلي من الجدول الدوري، وهي تتميز بأنها معادن صلبة ولكنها متفاعلة كيميائيًا بدرجة أقل من العناصر الانتقالية.

من الأمثلة على العناصر النادرة: اللانثانوم والسيريوم والبراسيوديميوم.

تُستخدم العناصر النادرة في مجموعة واسعة من التطبيقات، بما في ذلك أجهزة الليزر والمغناطيس والمصابيح الفلورية.
6. العناصر المشعة

تقع العناصر المشعة في الجزء العلوي من الجدول الدوري، وهي تتميز بأنها غير مستقرة وتتحلل إشعاعيًا بمرور الوقت.

من الأمثلة على العناصر المشعة: اليورانيوم والبلوتونيوم والراديوم.

يمكن استخدام العناصر المشعة في التطبيقات الطبية والصناعية، ولكنها أيضًا مواد خطرة تتطلب التعامل معها بعناية.

7. الغازات النبيلة

تقع الغازات النبيلة في الجزء الأيمن العلوي من الجدول الدوري، وهي تتميز بأنها خاملة كيميائيًا ولديها تفاعلية منخفضة للغاية.

من الأمثلة على الغازات النبيلة: الهيليوم والنيون والأرجون.

تُستخدم الغازات النبيلة في مجموعة متنوعة من التطبيقات، بما في ذلك الإضاءة واللحام والغوص.

خاتمة
يوفر الجدول الدوري الحديث إطارًا منهجيًا لتنظيم العناصر الكيميائية، مرتبة حسب العدد الذري المتزايد. إنه أداة قيمة لتفهم الخصائص الكيميائية والفيزيائية للعناصر، مما يسمح للعلماء بالتنبؤ بسلوك العناصر وتطوير مواد وتقنيات جديدة.