ترتيب العناصر الكيميائية حسب مندليف

مقدمة

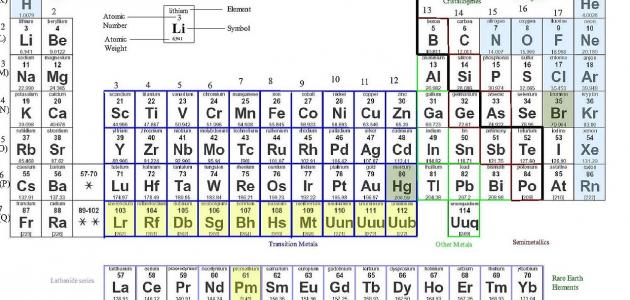
في عام 1869، اقترح الكيميائي الروسي ديمتري مندليف ترتيبًا للعناصر الكيميائية بناءً على تزايد أعدادها الذرية (عدد البروتونات في نواة الذرة). وُضع هذا الترتيب، المعروف باسم الجدول الدوري، في شكل جدول يحتوي على ثمانية عشر عمودًا، تُسمى المجموعات، وسبعة صفوف تُسمى الفترات.

مبادئ ترتيب مندليف

-
رتب مندليف العناصر بترتيب تصاعدي لأعدادها الذرية، وهي عدد البروتونات الموجودة في نواة الذرة.
-
وضع العناصر التي لها خصائص كيميائية متشابهة في نفس العمود (المجموعة).
-
وضع العناصر التي تتشابه في خصائصها الفيزيائية في نفس الصف (الفترة).

خصائص الجدول الدوري
{ |}
|}
-
يتكون الجدول الدوري من ثمانية عشر عمودًا وسبعة صفوف.
-
العناصر الموجودة في نفس المجموعة (العمود) لها نفس عدد إلكترونات التكافؤ، وهي الإلكترونات الموجودة في المستوى الخارجي للذرة.
-
تزداد خصائص العناصر المعدنية من اليسار إلى اليمين عبر فترة، وتزداد الخصائص اللافلزية من اليمين إلى اليسار عبر فترة.

أهمية الجدول الدوري

يمثل الجدول الدوري أداة أساسية للكيميائيين والعلماء الآخرين لأنه:

-
يوفر طريقة منهجية لتنظيم العناصر الكيميائية.
-
يساعد في التنبؤ بخصائص العناصر بناءً على موقعها في الجدول.
-
يُستخدم لتوجيه التصميم الاصطناعي للعناصر الجديدة.

استخدامات الجدول الدوري
{ |}
|}
يستخدم الجدول الدوري في مجموعة متنوعة من التطبيقات، منها:

-
تصنيف العناصر وفهم خصائصها.
-
التنبؤ بالخصائص الكيميائية والفيزيائية للعناصر الجديدة.
-
فهم التفاعلات الكيميائية وتصميم مواد جديدة.

تطوير الجدول الدوري

خضع الجدول الدوري لعدة مراجعات منذ اقتراحه لأول مرة في عام 1869. وقد أدت الاكتشافات اللاحقة لعناصر جديدة وتحسينات في فهم البنية الذرية إلى تعديلات وتوسيعات الجدول.

الجدول الدوري الحديث
{ |}
|}
يتكون الجدول الدوري الحديث من 118 عنصرًا، منها 94 عنصرًا موجودًا بشكل طبيعي على الأرض و24 عنصرًا تم تصنيعها في المختبر. ويتم ترتيب العناصر حسب أعدادها الذرية المتزايدة، مع وضع العناصر التي لها خصائص متشابهة في نفس المجموعة.

خاتمة

يعد الجدول الدوري أداة أساسية في الكيمياء وفروع العلوم الأخرى. وقد سمح بتنظيم العناصر الكيميائية وفهم خصائصها، مما أدى إلى تقدم كبير في فهم العالم الطبيعي. كما يستمر الجدول الدوري في التطور مع الاكتشافات الجديدة للعناصر وتقدم المعرفة العلمية.
