قوانين الغازات
مقدمة

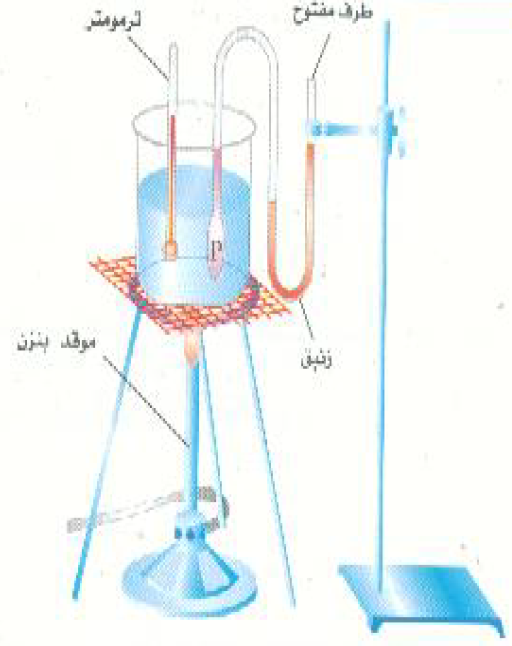
تُعتبر قوانين الغازات مجموعة من المبادئ الأساسية التي تصف سلوك الغازات في ظل ظروف مختلفة من حيث الحجم والضغط ودرجة الحرارة. وتُستخدم هذه القوانين على نطاق واسع في مجالات مختلفة مثل الكيمياء والفيزياء وهندسة العمليات.

قانون بويل

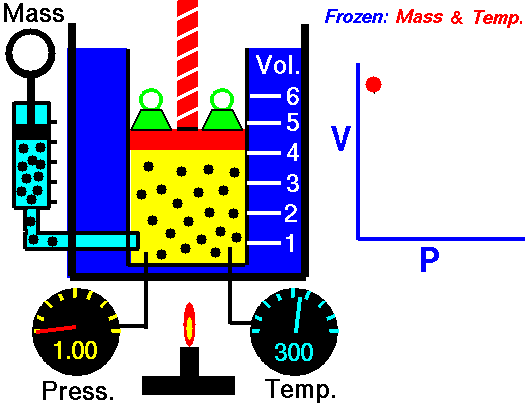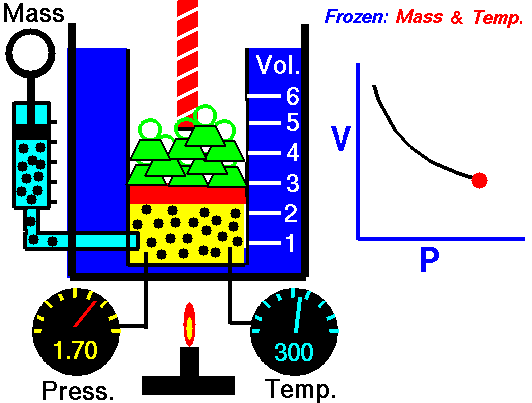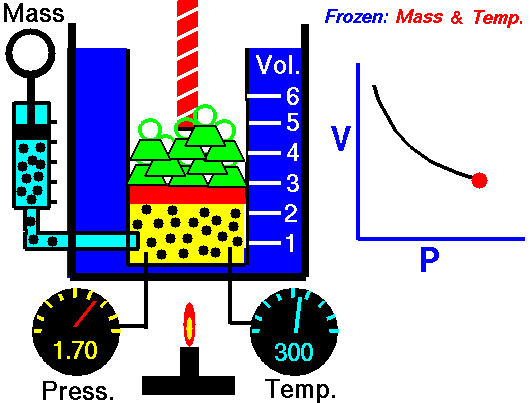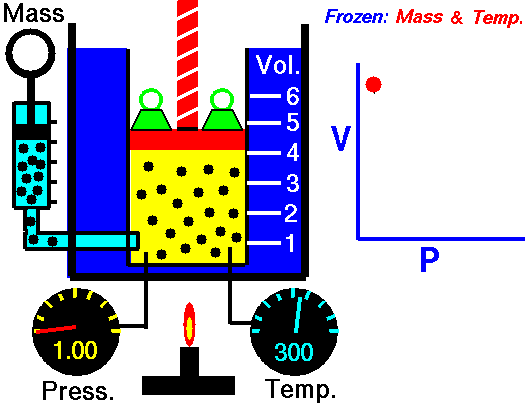
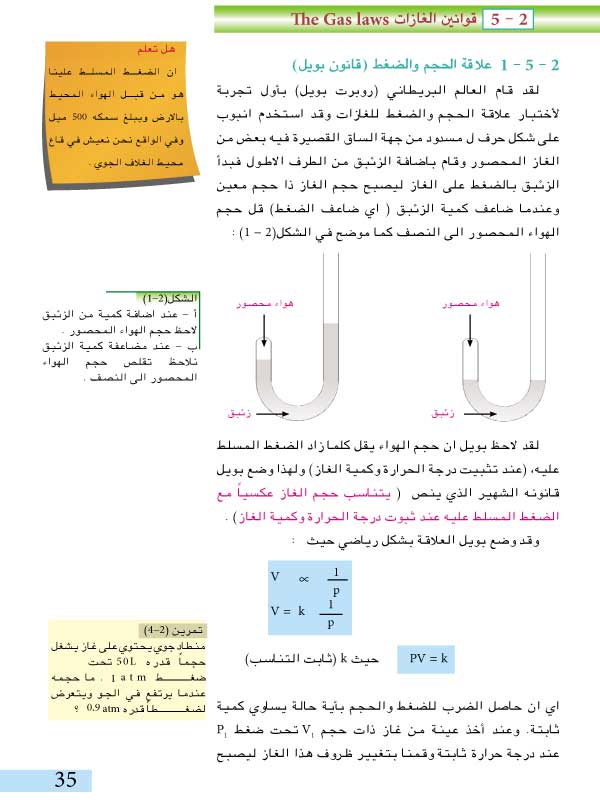
يُعرف قانون بويل أيضًا باسم قانون الحجم والضغط. ينص هذا القانون على أنه عند ثبات درجة الحرارة، يكون حجم الغاز عكسيًا متناسبًا مع ضغطه. بعبارة أخرى، عندما يزداد ضغط الغاز، ينخفض حجمه، والعكس صحيح. يمكن تمثيل هذا القانون بالمعادلة التالية:
{ |}
|}

PV = ثابت

حيث:

P: الضغط

V: الحجم
قانون شارل

يُعرف قانون شارل أيضًا باسم قانون الحجم ودرجة الحرارة. ينص هذا القانون على أنه عند ثبات الضغط، يكون حجم الغاز متناسبًا طرديًا مع درجة حرارته المطلقة. بعبارة أخرى، عندما ترتفع درجة حرارة الغاز، يزداد حجمه، والعكس صحيح. يمكن تمثيل هذا القانون بالمعادلة التالية:

V/T = ثابت
حيث:

T: درجة الحرارة المطلقة
قانون جاي-لوساك
يُعرف قانون جاي-لوساك أيضًا باسم قانون الضغط ودرجة الحرارة. ينص هذا القانون على أنه عند ثبات الحجم، يكون ضغط الغاز متناسبًا طرديًا مع درجة حرارته المطلقة. بعبارة أخرى، عندما ترتفع درجة حرارة الغاز، يزداد ضغطه، والعكس صحيح. يمكن تمثيل هذا القانون بالمعادلة التالية:
P/T = ثابت

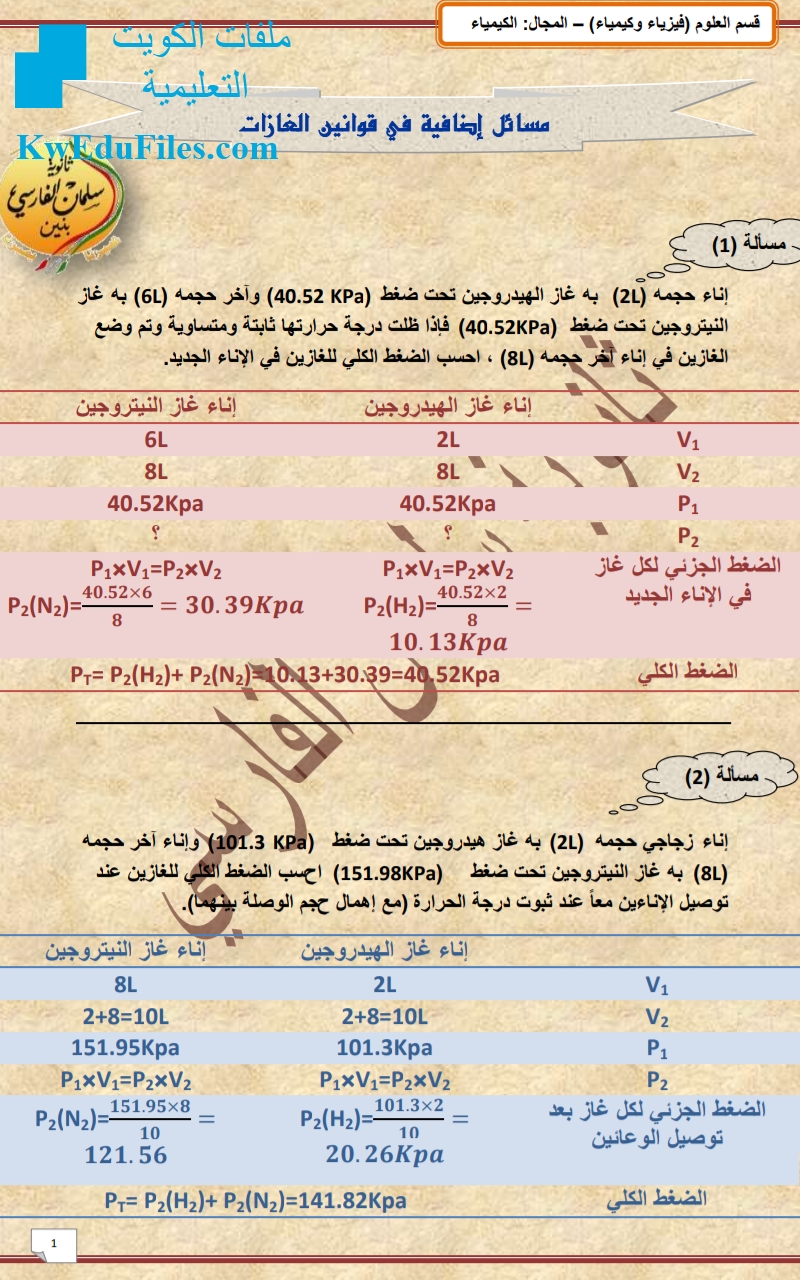
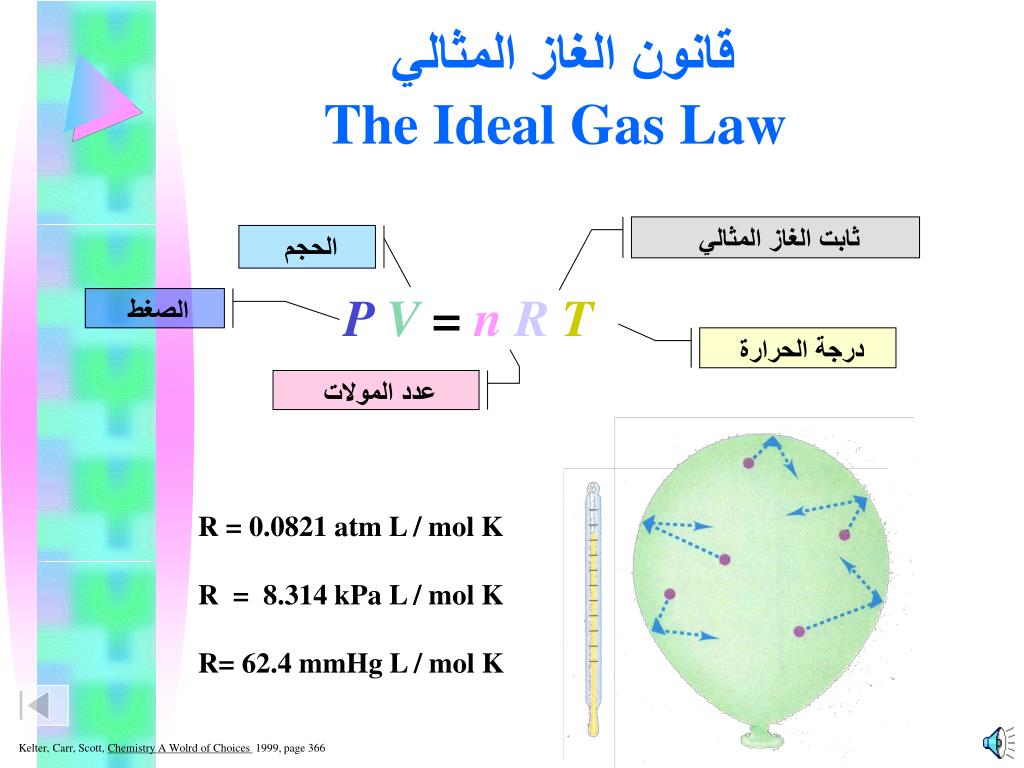
قانون الغازات المثالية

يُعرف قانون الغازات المثالية أيضًا باسم معادلة الحالة للغاز المثالي. ينص هذا القانون على أنه في ظل ظروف الضغط والحجم ودرجة الحرارة العادية، يتصرف الغاز المثالي وفقًا للمعادلة التالية:
{ |}
|}
PV = nRT
{ |}
|}
حيث:

n: عدد مولات الغاز
R: ثابت الغازات العالمي
قانون أفوجادرو
{ |}
|}
يُعرف قانون أفوجادرو أيضًا باسم قانون الحجم وعدد المولات. ينص هذا القانون على أنه عند نفس الظروف من الضغط ودرجة الحرارة، تحتوي أحجام متساوية من الغازات على نفس عدد الجسيمات. بعبارة أخرى، يكون عدد الجسيمات في الغاز متناسبًا مع حجمه عند ثبات الضغط ودرجة الحرارة.

قانون دالتون للضغوط الجزئية

يُعرف قانون دالتون للضغوط الجزئية أيضًا باسم قانون الضغوط الجزئية. ينص هذا القانون على أن الضغط الكلي لمزيج من الغازات غير المتفاعلة يساوي مجموع الضغوط الجزئية لكل غاز في الخليط. بعبارة أخرى، يساهم كل غاز في الخليط بضغطه الجزئي على الضغط الكلي.
تطبيقات قوانين الغازات
تُستخدم قوانين الغازات في مجموعة واسعة من التطبيقات، بما في ذلك:
– تحديد حجم غاز عند درجة حرارة أو ضغط مختلفين

– حساب ضغط غاز عند درجة حرارة أو حجم مختلفين
– تحويل وحدات الضغط والحجم ودرجة الحرارة

– تصميم الأجهزة التي تستخدم الغازات مثل المضخات والضاغطات
{ |}
|}
– فهم سلوك الغازات في العمليات الصناعية
خاتمة
تُعتبر قوانين الغازات أدوات قوية لفهم سلوك الغازات في ظل ظروف مختلفة. ويوفر فهم هذه القوانين أساسًا قويًا لحل المشكلات في مجالات مختلفة مثل الكيمياء والفيزياء وهندسة العمليات.