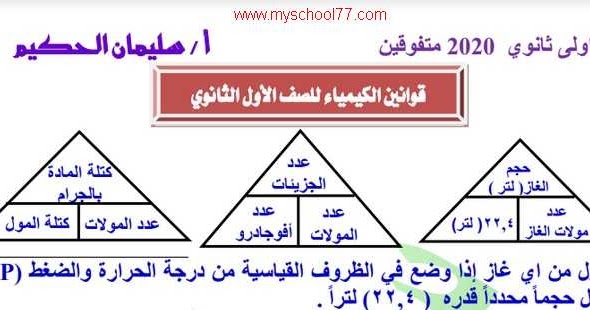
قوانين عدد المولات


مقدمة
يعتبر مفهوم عدد المولات من المفاهيم الأساسية في الكيمياء، وهو يمثل كمية المادة الموجودة في عينة معينة. وتُستخدم قوانين عدد المولات لحساب الكميات المختلفة للمواد المتفاعلة والناتجة في التفاعلات الكيميائية.


هناك عدة قوانين مختلفة تتعلق بعدد المولات، وفيما يلي نستعرض أهم هذه القوانين:
قانون حفظ الكتلة
ينص قانون حفظ الكتلة على أنه لا يمكن إنشاء أو تدمير المادة في تفاعل كيميائي. بعبارة أخرى، يجب أن يكون مجموع كتلة المواد المتفاعلة مساويًا لمجموع كتلة المواد الناتجة.
هذا القانون مهم للغاية في الكيمياء، حيث أنه يسمح لنا بتتبع حركة المادة خلال التفاعلات الكيميائية.
على سبيل المثال، إذا تفاعل 10 جرام من الهيدروجين مع 16 جرامًا من الأكسجين لإنتاج الماء، فإن كتلة الماء الناتج ستكون 26 جرامًا، أي مجموع كتلة الهيدروجين والأكسجين المتفاعلين.

قانون النسب المتعادلة

ينص قانون النسب المتعادلة على أنه عندما تتفاعل عناصر أو مركبات مختلفة لتكوين مركب جديد، فإنها تتفاعل دائمًا بنسب كتلة ثابتة.
هذا القانون مهم لأنه يسمح لنا بالتتنبأ بكميات المواد المتفاعلة والناتجة المطلوبة في تفاعل كيميائي.

على سبيل المثال، يتفاعل الهيدروجين والأكسجين دائمًا بنسبة كتلة 1:8 لإنتاج الماء. وهذا يعني أنه لإنتاج 1 جرام من الماء، نحتاج إلى 1/9 جرام من الهيدروجين و8/9 جرام من الأكسجين.
قانون النسب المتعددة

ينص قانون النسب المتعددة على أنه عندما تتفاعل عنصران أو أكثر لتكوين مركبات مختلفة، فإن نسب كتلة أحد العناصر إلى العنصر الآخر تكون في نسب صحيحة صغيرة.

هذا القانون مهم لأنه يساعدنا في تحديد الصيغ الكيميائية للمركبات المختلفة.
على سبيل المثال، يتفاعل الكربون مع الأكسجين لتكوين مركبين مختلفين، وهما أول أكسيد الكربون وثاني أكسيد الكربون. ونسبة كتلة الكربون إلى الأكسجين في أول أكسيد الكربون هي 1:1، بينما في ثاني أكسيد الكربون هي 1:2.
قانون الغازات المثالية
ينص قانون الغازات المثالية على أن حجم غاز ما يتناسب طرديًا مع درجة حرارته المطلقة ويتناسب عكسيًا مع ضغطه.
هذا القانون مهم لأنه يسمح لنا بحساب حجم غاز ما في ظروف مختلفة.

على سبيل المثال، إذا زاد حجم غاز ما من 1 لتر إلى 2 لتر، فإن درجة حرارته المطلقة تتضاعف أو ضغطه ينخفض إلى النصف.

قانون أفوجادرو

ينص قانون أفوجادرو على أن أحجام متساوية من الغازات عند نفس درجة الحرارة والضغط تحتوي على نفس عدد الجزيئات.
هذا القانون مهم لأنه يسمح لنا بحساب عدد الجزيئات في غاز ما.
على سبيل المثال، إذا كان لدينا حجمان متساويان من الأكسجين والهيدروجين عند نفس درجة الحرارة والضغط، فإن كلا الحجمين يحتويان على نفس عدد الجزيئات.
قانون التكافؤ الكيميائي
ينص قانون التكافؤ الكيميائي على أن عدد مولات الإلكترونات التي تفقدها ذرات عنصر ما في تفاعل كيميائي يساوي عدد مولات الإلكترونات التي تكتسبها ذرات عنصر آخر.
هذا القانون مهم لأنه يساعدنا في موازنة المعادلات الكيميائية.

على سبيل المثال، في التفاعل بين الصوديوم والكلور لتكوين كلوريد الصوديوم، يفقد ذرة الصوديوم إلكترونًا واحدًا، بينما تكتسب ذرة الكلور إلكترونًا واحدًا. وهذا يعني أن التفاعل متوازن من الناحية الكيميائية.

قوانين مولية أخرى

بالإضافة إلى القوانين المذكورة أعلاه، هناك قوانين مولية أخرى مهمة، مثل:
- قاعدة الضرب
- قاعدة القسمة
- قانون التفاضل

هذه القوانين مفيدة أيضًا في حساب الكميات المختلفة للمواد المتفاعلة والناتجة في التفاعلات الكيميائية.

الخاتمة

قوانين عدد المولات هي أدوات قوية تسمح لنا بفهم وفراغ التفاعلات الكيميائية. من خلال استخدام هذه القوانين، يمكننا التنبؤ بكميات المواد المتفاعلة والناتجة المطلوبة في تفاعل كيميائي، وحساب حجم الغاز ما في ظروف مختلفة، وموازنة المعادلات الكيميائية، والمزيد.