عدد الإلكترونات التي يمكن أن يستوعبها الغلاف
يمكن أن يستوعب كل غلاف إلكتروني عددًا معينًا من الإلكترونات، ويُعرف هذا العدد بالعدد الكم الرئيسي (n) للغلاف. ووفقًا لقاعدة الثمانيات، يمكن أن يستوعب الغلاف الثامن والأخير ثمانية إلكترونات كحد أقصى.

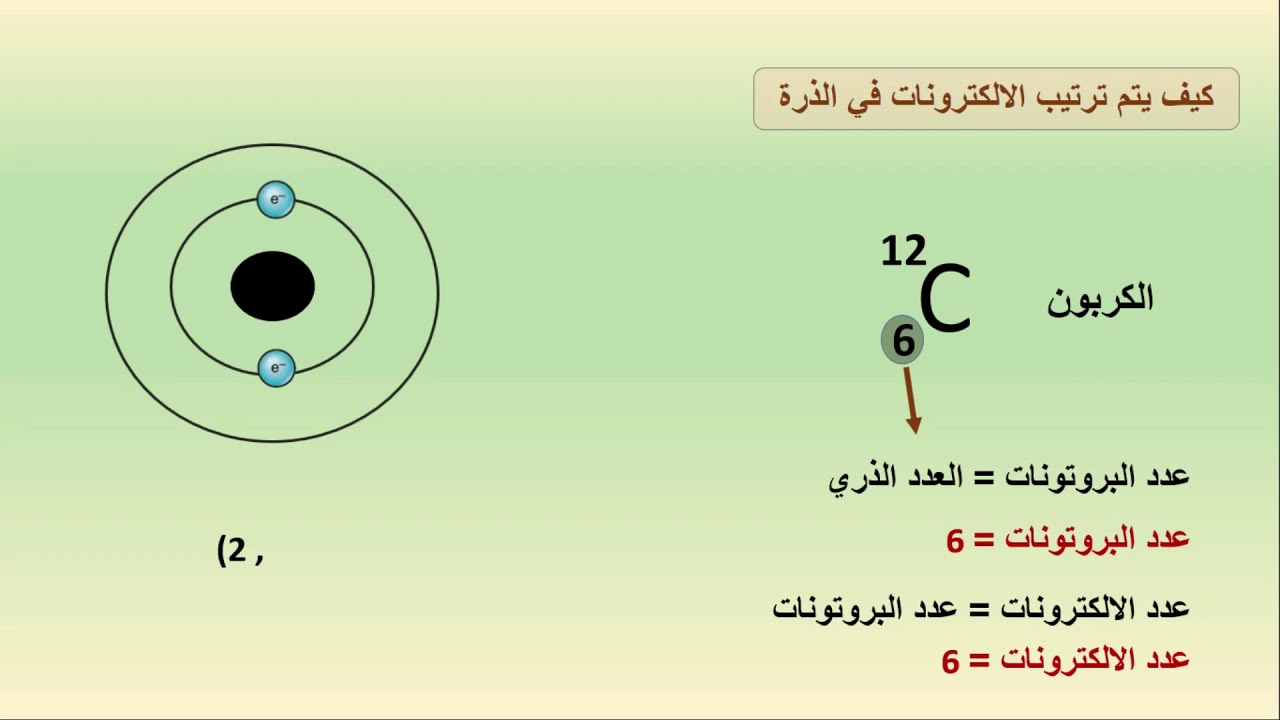
أكبر عدد من الإلكترونات في الغلاف الأول

يمكن أن يستوعب الغلاف الأول، وهو أقرب غلاف إلى النواة، إلكترونين فقط. هذا لأن العدد الكم الرئيسي للغلاف الأول هو 1، وعليه يمكن أن يحتوي على مدار واحد فقط، ولكل مدار إلكترونان كحد أقصى.

أكبر عدد من الإلكترونات في الغلاف الثاني

يمكن أن يستوعب الغلاف الثاني ثمانية إلكترونات. عدد الكم الرئيسي له هو 2، وبالتالي يمكن أن يحتوي على أربعة مدارات. ويمكن لكل مدار أن يستوعب إلكترونين، مما ينتج عنه إجمالي ثمانية إلكترونات.

أكبر عدد من الإلكترونات في الغلاف الثالث

يمكن أن يستوعب الغلاف الثالث 18 إلكترونًا. عدد الكم الرئيسي له هو 3، وبالتالي يمكن أن يحتوي على تسعة مدارات. لكل مدار إلكترونان، مما ينتج عنه إجمالي 18 إلكترونًا.

أكبر عدد من الإلكترونات في الغلاف الرابع

يمكن أن يستوعب الغلاف الرابع 32 إلكترونًا. عدد الكم الرئيسي له هو 4، وبالتالي يمكن أن يحتوي على 16 مدارًا. ولكل مدار إلكترونان، مما ينتج عنه إجمالي 32 إلكترونًا.

استثناءات لقاعدة الثمانيات

هناك بعض الاستثناءات لقاعدة الثمانيات، والتي تنص على أن الغلاف الخارجي للذرة يجب أن يحتوي على ثمانية إلكترونات ليكون مستقرًا. أحد الأمثلة على ذلك هو الهيدروجين، الذي يحتوي على إلكترون واحد فقط في غلافه الخارجي.

طاقة التأين

طاقة التأين هي مقدار الطاقة اللازمة لإزالة إلكترون من ذرة أو أيون. ترتبط طاقة التأين بعدد الإلكترونات في الغلاف الخارجي للذرة. فكلما زاد عدد الإلكترونات في الغلاف الخارجي، زادت طاقة التأين.

استنتاج

يمكن أن يستوعب كل غلاف إلكتروني عددًا معينًا من الإلكترونات، تُحدده قواعد محددة. ولعب عدد الإلكترونات في الغلاف الخارجي دورًا حيويًا في استقرار الذرة وتفاعلاتها الكيميائية. وفهم عدد الإلكترونات التي يمكن أن يستوعبها كل غلاف ضروري لفهم بنية الذرة وسلوكها.
