الجدول الدوري: الترتيب والخصائص

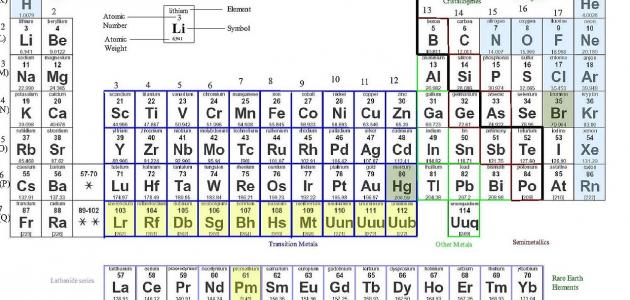
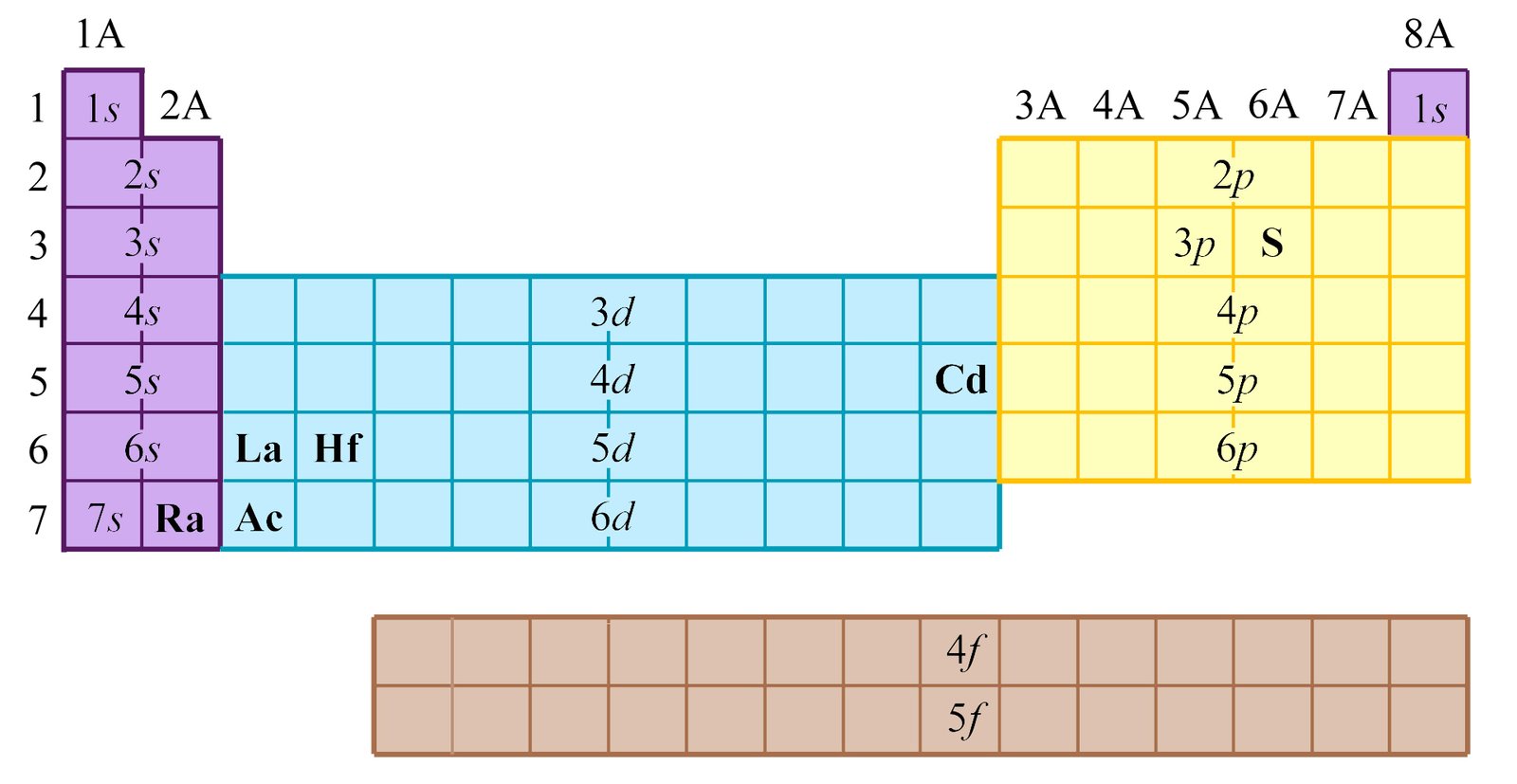
الجدول الدوري هو جدول يرتب العناصر الكيميائية وفقًا لخصائصها، بحيث توضع العناصر ذات الخصائص المتشابهة في مجموعات وأعمدة.

الترتيب في الجدول الدوري

تم ترتيب العناصر في الجدول الدوري بناءً على:

- العدد الذري: رقم البروتونات في نواة الذرة.
- التكوين الإلكتروني: ترتيب الإلكترونات في مدارات الذرة.
- الخواص الكيميائية: سلوك العناصر في التفاعلات الكيميائية.
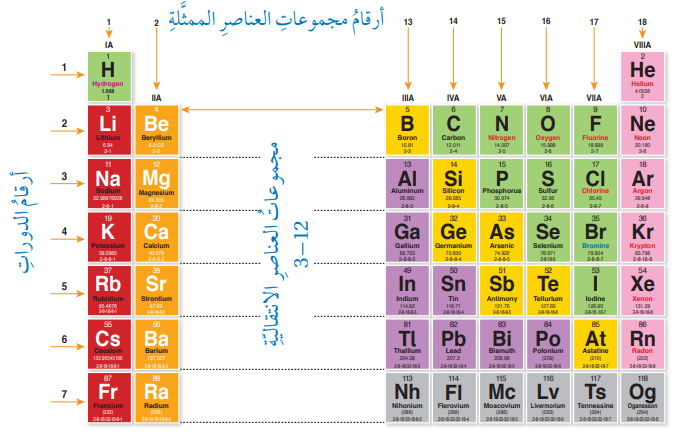
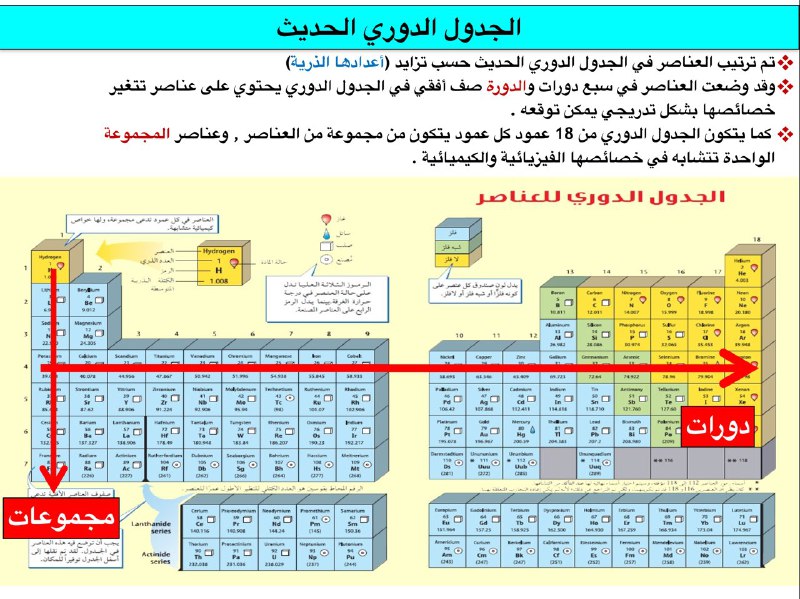
الدورات
تتكون الدورات من صفوف أفقية من عناصر الجدول الدوري. كل دورة تمثل مستوى طاقة رئيسيًا جديدًا للإلكترونات في الذرة.

- تحتوي الدورة الأولى على عنصرين: الهيدروجين والهيليوم.
- تحتوي الدورة الثانية على 8 عناصر: الليثيوم والبيريليوم والبورون والكربون والنيتروجين والأكسجين والفلور والنيون.
- تحتوي الدورة الثالثة على 8 عناصر: الصوديوم والمغنيسيوم والألمنيوم والسيليكون والفوسفور والكبريت والكلور والأرجون.
{ |}
|}
المجموعات
{ |}
|}
تتكون المجموعات من أعمدة رأسية من عناصر الجدول الدوري. كل مجموعة تمثل مجموعة من العناصر ذات التكوين الإلكتروني الخارجي المتشابه، مما يؤدي إلى خصائص كيميائية متشابهة.

- المجموعة 1: عناصر المعادن القلوية (ليثيوم، صوديوم، بوتاسيوم، روبيديوم، سيزيوم، فرانسيوم)
- المجموعة 2: عناصر المعادن القلوية الترابية (بيريليوم، مغنيسيوم، كالسيوم، سترونشيوم، باريوم، راديوم)
- المجموعة 17: عناصر الهالوجينات (فلور، كلور، بروم، يود، أستاتين، تينيسين)

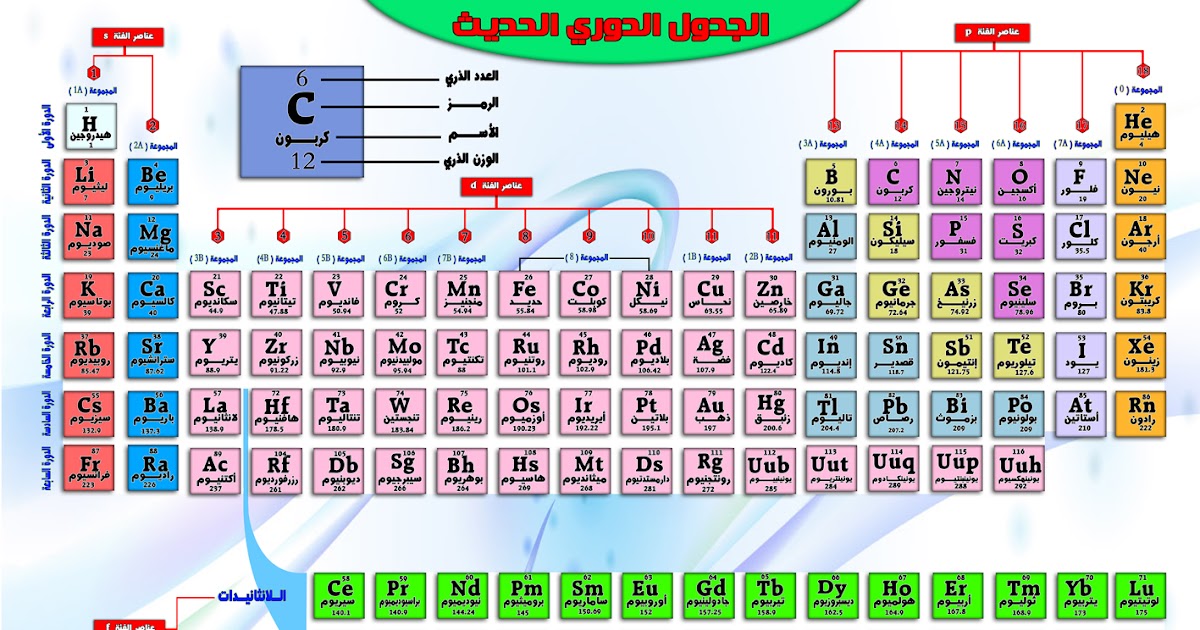
العناصر الانتقالية

العناصر الانتقالية هي العناصر الموجودة في المجموعات من 3 إلى 12 في الجدول الدوري. تتميز بإلكترونات مستمرة في مدارات d الخاصة بها، وهذا يعطيها خصائص مميزة مثل التوصيل الكهربائي والمغناطيسية.
- الصفوف الانتقالية: هي مجموعات من 10 عناصر تقع في فترة واحدة من الجدول الدوري.
- الكتل الانتقالية: هي مجموعات من العناصر التي تشترك في نفس تكوينها الإلكتروني الخارجي وحالات الأكسدة المتشابهة.
- عدد التأكسد: يشير إلى عدد الإلكترونات التي يمكن أن تكتسبها أو تفقدها ذرة من العنصر أثناء تكوين الرابطة الكيميائية.
{ |}
|}
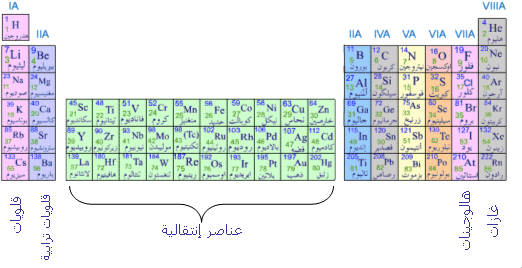
فلزات اللافلزات وشبه الفلزات
يتم تصنيف العناصر في الجدول الدوري إلى فلزات ولافلزات وشبه فلزات بناءً على خصائصها الفيزيائية والكيميائية.
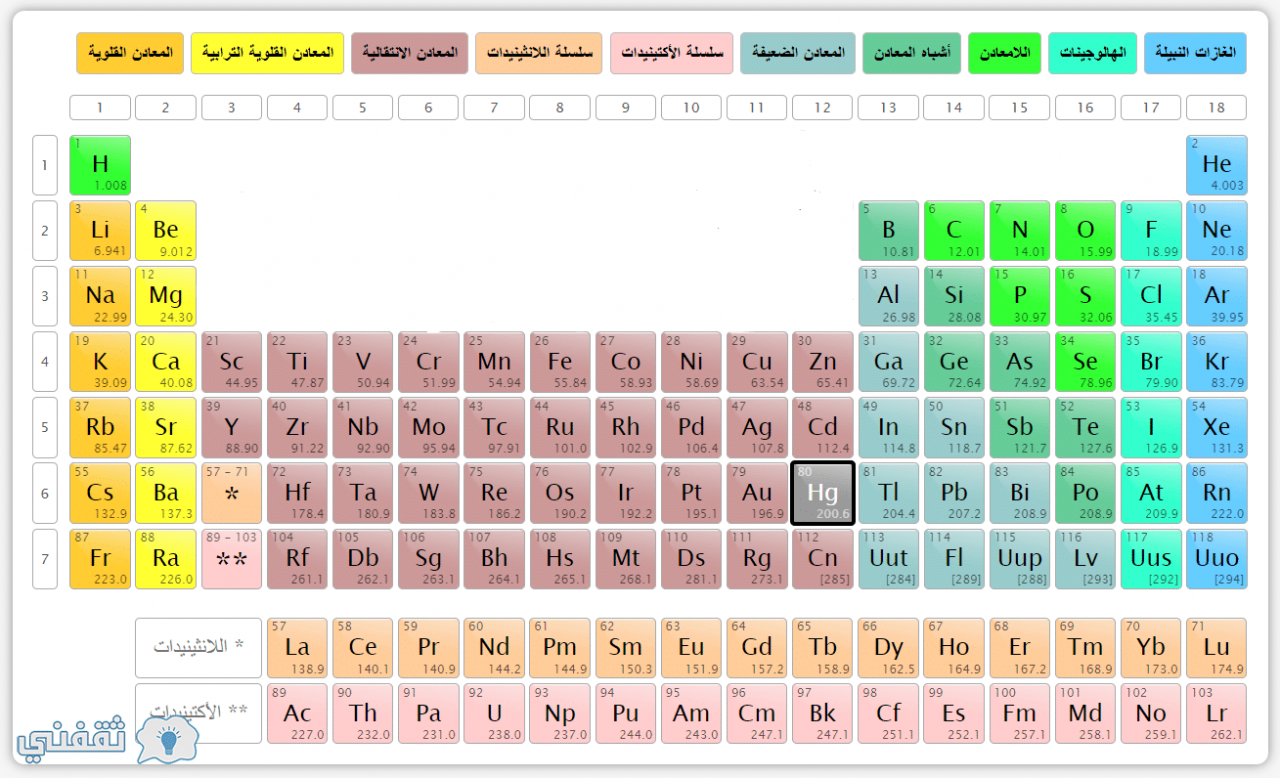
- الفلزات: هي موصلات جيدة للكهرباء والحرارة، ولها لمعان، ويمكن دقها إلى صفائح وتشكيلها إلى أسلاك.
- اللافلزات: هي عوازل للكهرباء والحرارة، ولها مظهر غير لامع، وهشة ولا يمكن دقها أو تشكيلها إلى أسلاك.
- شبه الفلزات: لها خصائص بين الفلزات واللافلزات، فهي موصلات ضعيفة للكهرباء والحرارة، ولها مظهر لامع ولكنها يمكن أن تكون هشة أو قابلة للدق.

الخصائص الدورية
تظهر العناصر في الجدول الدوري خصائص دورية، حيث تتكرر الخصائص بشكل منتظم مع زيادة العدد الذري.

- نصف القطر الذري: يزداد نصف القطر الذري، وهو المسافة من نواة الذرة إلى أبعد مسافة إلكترونية، عمومًا مع زيادة العدد الذري للأنساق.
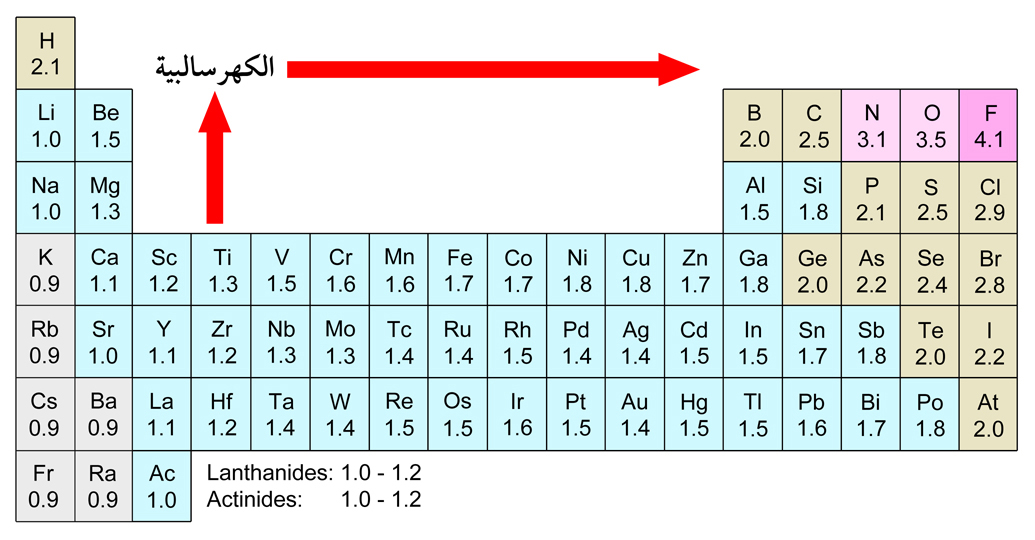
- طاقة التأين: هي طاقة مطلوبة لإزالة إلكترون من الذرة، وتزداد عمومًا مع زيادة العدد الذري للأعمدة.
- الألفة الإلكترونية: هي طاقة تطلق عندما يكتسب ذرة إلكترونًا، وتزداد عمومًا مع زيادة العدد الذري للأعمدة.

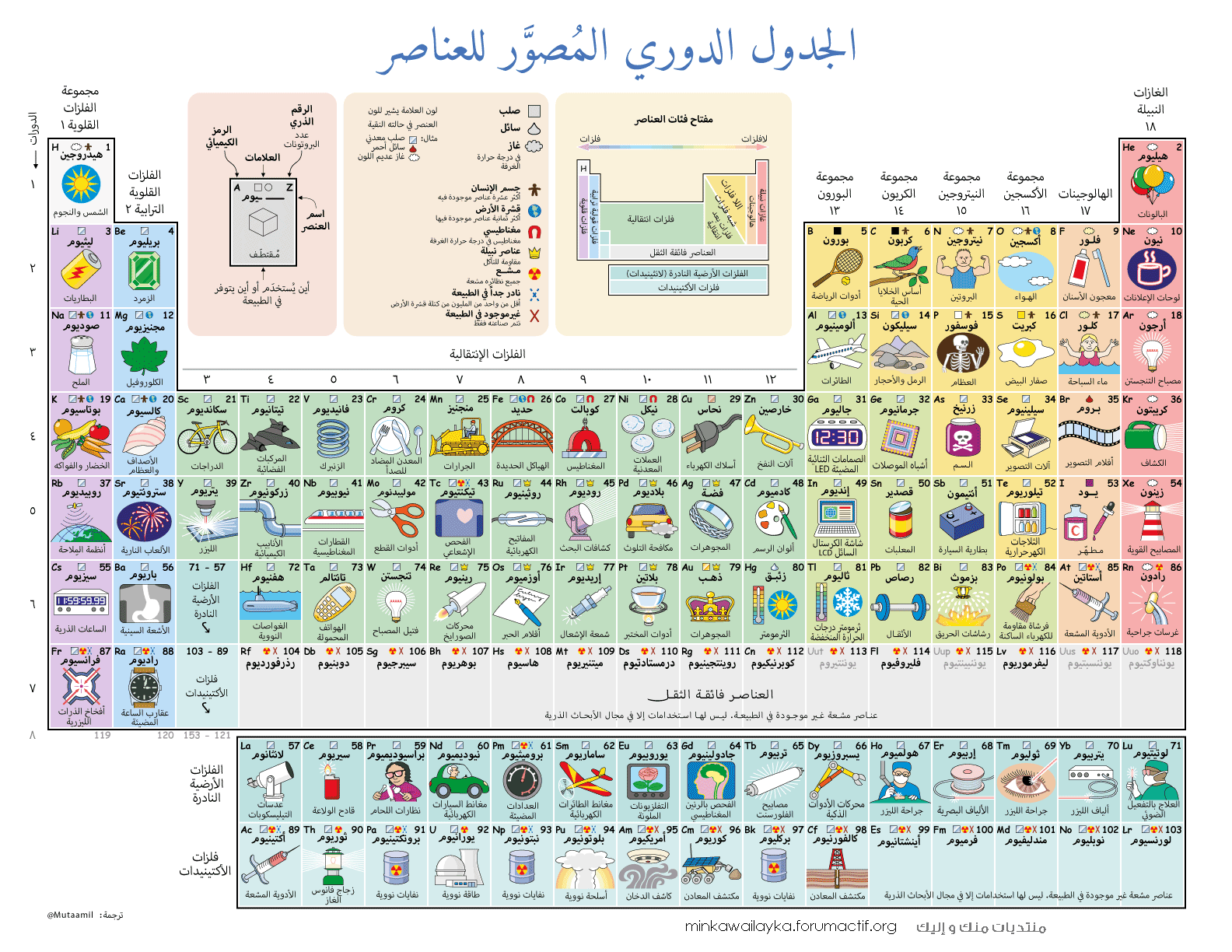
الاستخدامات والتطبيقات
تستخدم العناصر الموجودة في الجدول الدوري في مجموعة واسعة من التطبيقات، بما في ذلك:

- المواد الهيكلية: تستخدم المعادن مثل الحديد والألمنيوم في بناء المباني والمركبات.
- المواد الكهربائية: تستخدم العناصر مثل النحاس والذهب في صنع الأسلاك الكهربائية والموصلات.
- المواد الكيميائية: تستخدم العناصر مثل الكلور والكبريت في إنتاج المواد الكيميائية مثل حمض الهيدروكلوريك وحمض الكبريتيك.
{ |}
|}
الخلاصة
{ |}
|}
الجدول الدوري هو أداة قوية لتنظيم العناصر الكيميائية وتوقع خصائصها. يتم ترتيب العناصر في الجدول الدوري بناءً على عددها الذري وتكوينها الإلكتروني وخصائصها الكيميائية، مما يسمح للعلماء بتحديد أنماط وتوقعات دورية في الخصائص الكيميائية والفيزيائية للعناصر.
