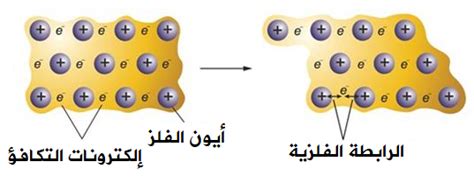
الرابطة الفلزية.
الإجابة الصحيحة هي : هي رابطة تنشأ نتيجة التجاذب بين الكترونات.
الرابطة الفلزية
الرابطة الفلزية هي نوع من الروابط الكيميائية التي تحدث بين ذرات الفلزات. تتميز هذه الرابطة بأنها قوية جدًا ومتجانسة، وتسمح للفطزات بالاتحاد مع بعضها البعض لتكوين شبكة كريستالية معدنية.
خصائص الرابطة الفلزية
إلكترونات التكافؤ الحرة: تميل ذرات الفلزات إلى فقدان إلكترونات التكافؤ لديها بسهولة، مما يؤدي إلى تكوين أيونات موجبة متعددة التكافؤ.
بحر من الإلكترونات: تتحرك إلكترونات التكافؤ هذه بحرية بين ذرات الفلز، وتُعرف باسم “بحر الإلكترونات”.
قوة الرابطة: تكون روابط الفلزات قوية جدًا بسبب التجاذب الكهروستاتيكي بين الأيونات الموجبة في الشبكة والبحر السلبي للإلكترونات.
أنواع الروابط الفلزية
توجد نوعان رئيسيان من الروابط الفلزية:
1. الرابطة الفلزية البسيطة: يحدث هذا النوع من الرابطة في الفلزات البسيطة مثل الصوديوم والبوتاسيوم. في هذه الرابطة، يكون لكل أيون موجب إلكترونين تكافؤ حرين متحركين بحرية في الشبكة.
2. الرابطة الفلزية المعقدة: تحدث هذه الرابطة في الفلزات الانتقالية مثل الحديد والنحاس. في هذه الرابطة، تكون إلكترونات التكافؤ غير متمركزة بالكامل في الشبكة ولكنها تتحرك أيضًا بين المدارات الفرعية المختلفة.
خصائص المعادن
تعطي الرابطة الفلزية المعادن خصائص مميزة، بما في ذلك:
اللمعان: ينتج اللمعان المعدني عن انعكاس الضوء من سطح المعدن بسبب بحر الإلكترونات.
الليونة: تكون المعادن لينة لأنها يمكن لأيوناتها الموجبة التحرك بسهولة في الشبكة دون كسر الرابطة.
اللدونة: تكون المعادن لينة لأنها يمكن تشكيلها إلى أشكال مختلفة دون كسر الروابط.
ناقلية الحرارة والكهرباء: تسمح إلكترونات التكافؤ الحرة للمعادن بنقل الحرارة والكهرباء بسهولة.
تطبيقات الرابطة الفلزية
تُستخدم الرابطة الفلزية في مجموعة واسعة من التطبيقات، منها:
الموصلات: تُستخدم المعادن كموصلات كهربائية وحرارية بسبب قدرتها العالية على توصيل التيار الكهربائي والحرارة.
الأسلاك والكابلات: تُستخدم المعادن، مثل النحاس والألومنيوم، في تصنيع الأسلاك والكابلات لنقل الكهرباء والبيانات.
الهياكل والأدوات: تُستخدم المعادن، مثل الحديد والصلب، في تصنيع الهياكل والأدوات بسبب قوتها ومرونتها.
تآكل المعادن
تتآكل المعادن عندما تتفاعل مع عناصر أخرى في البيئة، مثل الأكسجين والماء. يحدث التآكل عادةً عندما تفقد المعادن إلكترونات التكافؤ وتشكل رابطة جديدة مع العناصر الأخرى.
الوقاية من التآكل
يمكن الوقاية من تآكل المعادن من خلال عدة طرق، منها:
الطلاء: يمكن طلاء المعادن بطلاء وقائي، مثل الطلاء أو المينا، لحماية السطح من التآكل.
السبائك: يمكن إضافة معادن أخرى إلى المعدن لتكوين سبيكة أكثر مقاومة للتآكل.
الحماية الكاثودية: يمكن حماية المعادن عن طريق توصيلها بمعدن أكثر نشاطًا كيميائيًا، والذي يتآكل بدلاً من المعدن المراد حمايته.
الرابطة الفلزية هي رابطة كيميائية قوية ومتجانسة تمنح المعادن خصائص مميزة، مثل اللمعان والليونة واللدونة وناقلية الحرارة والكهرباء. تُستخدم المعادن في مجموعة واسعة من التطبيقات بسبب هذه الخصائص، ولكنها عرضة للتآكل في ظل ظروف معينة. يمكن الوقاية من التآكل من خلال الطلاء أو السبائك أو الحماية الكاثودية.