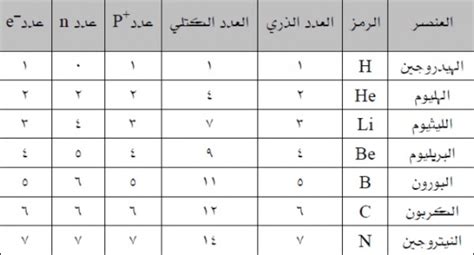
العدد الذري هو.
الإجابة الصحيحة هي : عدد البروتونات الموجودة في نواة الذرة.
العدد الذري
العدد الذري هو خاصية فيزيائية أساسية لعنصر كيميائي يمثل عدد البروتونات الموجودة في نواة ذرة هذا العنصر. يحدد العدد الذري نوع العنصر وخصائصه الكيميائية والفيزيائية.
خصائص العدد الذري
متفرد: لكل عنصر عدد ذري فريد يميزه عن العناصر الأخرى.
غير قابل للتغير: لا يمكن تغيير العدد الذري لذرة عن طريق التفاعلات الكيميائية العادية.
يحافظ على النوع: العدد الذري هو الذي يحدد نوع العنصر، فذرة بها عدد ذري معين ستكون دائمًا من نفس العنصر، بغض النظر عن الشكل أو الحالة التي تتواجد بها.
أهمية العدد الذري
تصنيف العناصر: يتم استخدام العدد الذري لترتيب العناصر في الجدول الدوري وفقًا لزيادة العدد الذري.
تحديد الخصائص الكيميائية: يحدد العدد الذري عدد الإلكترونات في غلاف التكافؤ للذرة، مما يؤثر بشكل مباشر على خصائصها الكيميائية.
التطبيقات العملية: يتم استخدام العدد الذري في مجموعة واسعة من التطبيقات، بما في ذلك تحديد الهوية الكيميائية للعناصر، والتحليل الطيفي، والطب النووي.
الترتيب الدوري للعدد الذري
يتم ترتيب العناصر في الجدول الدوري بزيادة العدد الذري من اليسار إلى اليمين ومن أعلى إلى أسفل. يقع العناصر ذات العدد الذري المتشابه في نفس العمود، والمعروف باسم المجموعة. وتقع العناصر ذات العدد الذري المتزايد في نفس الصف، والمعروف باسم الدورة.
دلالات ترتيب العدد الذري
يقدم ترتيب العدد الذري في الجدول الدوري معلومات قيمة حول خصائص العناصر:
المجموعات: تميل العناصر في نفس المجموعة إلى إظهار خصائص كيميائية متشابهة لأنها تحتوي على عدد متساوٍ من الإلكترونات في غلاف التكافؤ.
الدورات: تميل العناصر في نفس الدورة إلى إظهار خصائص كيميائية متباينة لأنها تحتوي على عدد مختلف من غلافات الإلكترون.
الاتجاهات الدورية: تظهر العناصر اتجاهات دورية في خصائصها الكيميائية والفيزيائية عند زيادة العدد الذري عبر الدورات.
الاستثناءات في ترتيب العدد الذري
توجد استثناءان رئيسيان في ترتيب الجدول الدوري:
الهيليوم: يتم وضع الهيليوم عادةً في المجموعة 18 (الغازات النبيلة)، على الرغم من أنه يحتوي على عدد ذري 2 ويتم تصنيفه عادةً على أنه في المجموعة 2 (المعادن القلوية الترابية).
اللانتانيدات والأكتينيدات: يتم وضع اللانتانيدات والأكتينيدات في مجموعتين منفصلتين أسفل الجدول الرئيسي، على الرغم من وجودها بين المجموعتين 3 و4.
العدد الذري والتفاعلات الكيميائية
لا يتغير العدد الذري للذرة خلال التفاعلات الكيميائية العادية. هذا يعني أن العناصر لا يمكن أن تتحول إلى عناصر أخرى من خلال التفاعلات الكيميائية. يمكن أن تتغير ترتيبات الإلكترونات فقط، مما يؤدي إلى تكوين جزيئات ومركبات مختلفة.
الاستخدامات العملية للعدد الذري
يتم استخدام العدد الذري في العديد من التطبيقات العملية، بما في ذلك:
التحليل الطيفي: يستخدم التحليل الطيفي لتحديد العناصر الموجودة في عينة من خلال تحليل أطياف الإشعاع المنبعثة أو الممتصة.
التحديد الكيميائي: يتم استخدام العدد الذري لتحديد العناصر بطرق مختلفة، مثل التحليل الوزني والحجمي والطرق المطيافية.
الطب النووي: يتم استخدام النظائر المشعة للعناصر في الطب النووي لتشخيص وعلاج الأمراض. يتم اختيار النظائر المشعة بناءً على خصائصها النووية، بما في ذلك العدد الذري.
العدد الذري هو خاصية فيزيائية أساسية لعنصر كيميائي ومحدد رئيسي لخصائصه وتصنيفه. يتم استخدامه في مجموعة متنوعة من التطبيقات العملية ويوفر أساسًا لفهم الكيمياء.